微生物检测中菌悬液不会制备,化验结果怎么能保证准确?
一、操作流程
这里以大家最常用的大肠埃希菌为例,其它菌种方法类似。
1,菌种制备:从菌种保藏管中吸取少量菌液,转接到新鲜的TSB中,于30℃-35℃培养箱中培养18-24小时。
2,稀释:取步骤1的培养物1mL,加入到9mL的pH7.0氯化钠蛋白质缓冲液中,进行倍比稀释。
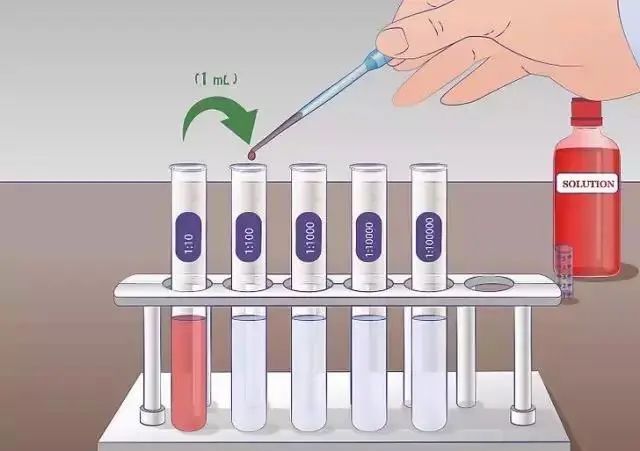
3,平板计数:取稀释好的菌液,一般取3个稀释级,每个梯度取2mL,分别加入两块90cm的平皿中,每皿加入1mL菌液,倾注45℃左右的已经经过确定的TSA培养基,轻轻摇匀,静置,培养基凝固后,置30-35℃培养箱中倒置培养48小时。
4,菌落计数:将培养后的平板,置于菌落计数器下进行菌落计数,以确定哪个稀释级的浓度能够满足测试的要求。
二、对应注意事项
1,菌种制备:也可以使用TSA平板进行培养,如果转接的是冷冻保藏管中的菌,最好再转接一次,使用第二次转接的菌种。
2,稀释:取菌液的时候,需要先对菌液进行振荡或吹打混匀,方可吸取菌液。可以不用进行倍比稀释,只要能保证最后加入到测试样品中的菌的数量符合要求即可。
3,平板计数:取菌液时同样需要先将试管中的菌液进行混匀。
4,培养基菌落计数:不建议逐日观察结果,因为平板中可能有凝集水, 逐日观察拿动平板,可能会导致水落到菌落上,菌跟着水流到下一个空白地方,导致结果不准确;另外如果是霉菌,因为有孢子,拿动也会导致孢子落到平板空白地方,影响结果。
三、事后思考
1、菌液的作用
菌悬液使用有时效性要求:
2020版《中国药典》和《欧洲药典》8.0版要求如果放置在室温,菌悬液必须在2小时内使用,如果放置在2-8℃保存,可以在24小时内使用。
那么问题来了,菌悬液的菌的数量需要在48小时后才能确定,但是在24小时之内菌悬液必须使用,所以在不知道菌含量的情况下,样品测试需要做至少三个梯度。
笔者之前在微生物 做了5次的菌悬液制备,为了保证实验的成功,每次都是要做三个梯度,虽然大多数都是同一个稀释级的含量符合要求,但是还是偶尔有另一个稀释级才符合要求的时候,所以笔者每次都乖乖的做三个梯度的测试,还好笔者那个时候依据的法规中,日常的无菌检查和控制菌检查中没有阳性对照的要求。
这里说的三个梯度不是说只是计数,而是菌悬液实际运用的测试中也需要三个梯度,举个例子,某个无菌产品无菌检查中的阳性对照测试,需要做三个对照。当然,同样的产品方法适用性,培养基促生长测试也是如此。流程图如下:
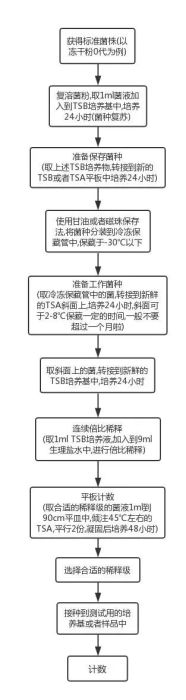
2、步骤的繁琐
这个流程图中,还是省略了一些步骤,一句话带过的倍比稀释,做过的小伙伴们知道,这个说起来容易做起来难。
另外在接收菌种和从冷冻保藏管中取出菌种来使用时,还需要进行相应的鉴定,所以不要觉得这个流程好冗长,其实已经是简单版的。
食品微生物检测
展源
何发
相关文章
-
检测有机氯类农药,气相色谱法检测法
2021-01-12
-

食品微生物检测流程
2024-07-31
-

食品生产环境中的微生物检测
2020-05-27
-
食品微生物检测 操作要求
2020-05-27
-

微生物检测基础知识大全!
2024-03-25
-

NGS在病原微生物检测中的应用
2020-12-18
-

微生物检测时的一些注意事项
2024-06-06
-

【收藏】微生物检测注意事项
2024-06-07
-

微生物检测中的CFU是什么?
2024-01-30
-
如何正确制备微生物检测培养基?
2020-05-27

加载更多