8步轻松搞定化学试剂配制!
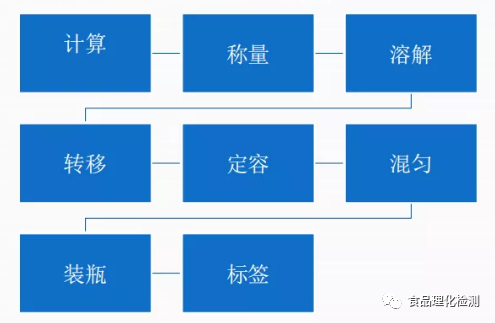
一、计算
1、计算-质量分数(w/w)
100克溶液(溶剂+溶质)中含有溶质的克数,单位: %或g/ 100g

一般不做特殊说明的百分含量,就是指质量分数。
质量分数-例子
现有100g溶质质量分数为10%的NaOH溶液,若将溶液中溶质的质量分数减小一半,应加水()g,若将溶液中溶质的质量分数增大一倍,应加入NaOH()g。
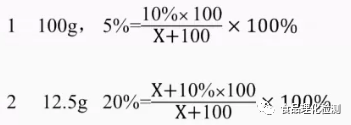
例:如何配制5%乙酸溶液?取多少乙酸定容至1000mL?

2、计算-质量摩尔浓度
溶液中某溶质的物质的量除以溶剂的质量,称为该溶质的质量摩尔浓度。
质量摩尔浓度=溶质摩尔数/溶剂质量 单位mol/kg
质量摩尔浓度与物质的量浓度相比,前者不随温度变化,在要求精确浓度时,必须用质量摩尔浓度表示。但对于一般稀溶液来说,其密度近似等于水的密度,可以近似认为c(mol/L) =b(mol/kg)
3、计算-质量比浓度
指两种固体试剂相互混合的表示方法。
例:
钙指示剂在水溶液中不稳定,也容易变质,不适于配成水溶液,所以通常是与干燥的NaCL混合后直接将固体加入待测溶液中使用。
1%钙指示剂(1+100) : 1克钙指示剂加100克氯化钠。
甲基百里香酚蓝指示剂
称取lg甲基百里香酚蓝和100g硝酸钾,混匀,研细。
4、计算-体积分数(体积百分浓度)
100mL溶液中所含溶质的体积(mL)数,一般用来表示溶质为液体的溶液,如乙醇(95%)溶液。
单位: % (V/V)。
常用于表示酒类样品的酒精度含量。
5、计算-体积比浓度
指用溶质与溶剂的体积比表示的浓度。
例1:1盐酸,即表示1体积量的盐酸和1体积量的水混合的溶液。
H2SO4(1+4)即表示此种硫酸水溶液是由1体积的浓硫酸(相对密度1.84) 与4体积的水混合而成。
体积比浓度只在对浓度要求不太精确时使用。
6、计算-物质的量浓度
单位体积溶液中所含溶质B的物质的量,符号为C,单位:mol/L
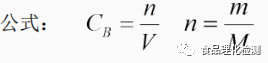
摩尔质量: M,单位g/mol, 在数值上等于该物质的相对原子质量或相对分子质量。
二、称量
器具:电子天平、烧杯或称量纸、药匙或滴管、量筒
称量方法:
1、直接称量法:
将称量物放在天平盘上直接称量物体的质量;
2、固定质量称量法:
又称增量法。此法用于称量某一固定质量的试剂(如基准物质)或试样。这种称量操作的速度慢,适于称量不易吸潮、在空气中能稳定存在的粉末状或小颗粒物品。
3、递减称量法:
又称减量法。在称量过程中物质易吸水、易氧化或易与CO2等反应时,可选择此法。可连续称取若干份试样,节省时间。
通过先将样品放于称量瓶中,置于天平盘上,称取样品和称量瓶的重量,然后取出所需的试样量,再称得剩余样品和称量瓶的重量,两次称量之差,即为所需试样的重量。
操作:根据试剂性质,准确称量一定量的试剂于称量纸或小烧杯中,易潮解或具有腐蚀性的试剂必须放在玻璃器皿中称量,动作要迅速。
(1)试剂不能与手接触,要用洁净的药匙,量简或滴管取用试剂。
(2)不能用同一种工具同时连续取用多种试剂。
(3)试剂取用后一定要将瓶塞盖紧,不可放错瓶盖和滴管,用完后将瓶放回原处。
(4)已取出的试剂不能再放回原试剂瓶内。
三、溶解
相关器具:玻璃棒、烧杯。
加热:水浴加热直接加热溶剂。
注意在容器上盖表面皿,以防止液体蒸发。
如加热,需将溶液冷却至室温后才能进行下一步操作。
四、转移
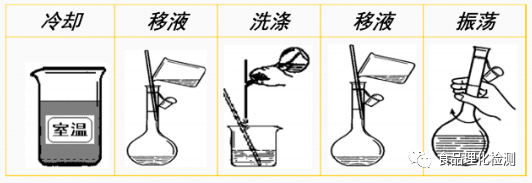
五、定容
当试剂注入到刻度线以下1~2cm处,改用滴管定容至刻度处。
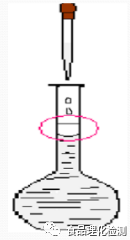
六、混匀
塞好瓶塞,用食指摁住瓶塞,用另一只手托住瓶底,把容量瓶反复倒转,使溶液混合均匀。
七、装瓶
调节pH值(根据需要)
试剂瓶
用途:
1.细口瓶:存放液体试剂
2.广口瓶:存放固体试剂
3.棕色:存放怕光试剂
注意事项:
不能加热、不能在其中配制溶液,加碱液的瓶子用橡胶塞,磨口要原配,倾倒液体时标签向手心。
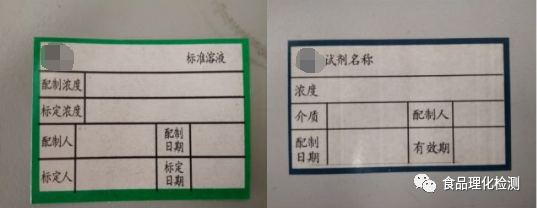
八、贴标签
内容应包括溶液名称、浓度及单位、配制日期、配制人、有效期、编号等。
展源
何发
相关文章
-

化学试剂的保质期
2021-07-20
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

化学试剂纯度和分级
2023-11-30
-

化学试剂的有效期?
2023-02-10
-

化学试剂的管理
2022-07-08
-

一般化学试剂知识介绍
2020-05-27
-

如何确定化学试剂的有效期?
2022-11-16
-

化学试剂级别及简称宝典
2020-05-27

加载更多