湿电子化学品,又称超净高纯试剂或工艺化学品,是指主体成分纯度大于 99.99%,杂质离子和微粒数符合严格要求的化学试剂。主要以上游硫酸、 盐酸、 氢氟酸、 氨水、 氢氧化钠、 氢氧化钾、 丙酮、 乙醇、 异丙醇等为原料,经过预处理、 过滤、 提纯等工艺生产得到的高纯度产品。
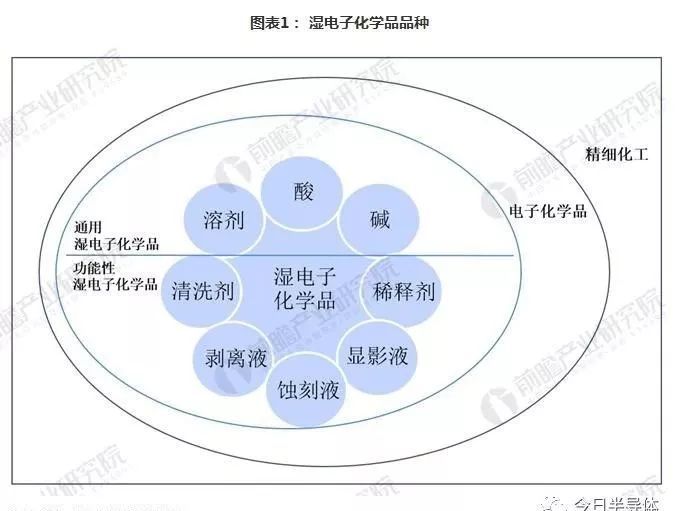
湿电子化学品按用途主要分为通用化学品和功能性化学品两类。其中通用化学品以高纯溶剂为主,例如氧化氢、氢氟酸、硫酸、磷酸、盐酸、硝酸等;
功能性化学品指通过复配手段达到特殊功能、满足制造中特殊工艺需求的配方类或复配类化学品,主要包括显影液、剥离液、清洗液、刻蚀液等。
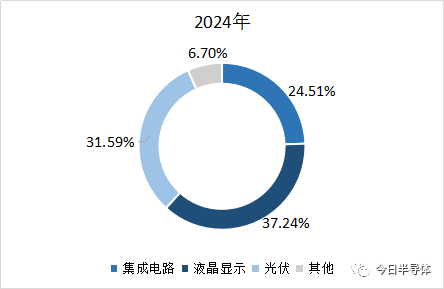
湿电子化学品目前广泛应用在半导体、平板显示、太阳能电池等多个领域,其中液晶面板领域增速快。即按下游产品应用的工艺环节分,主要有平板显示制造工艺的应用、半导体制造工艺的应用及太阳能电池板制造工艺的应用。
其中平板显示制造领域对湿电子化学品的需求量最高,半导体制造工艺用湿电子化学品是技术要求最高,太阳能电池板制造用湿电子化学品盈利能力一般。
湿电子化学品主要应用在半导体、平板显示、太阳能光伏领域等微电子器件制造领域,广泛应用于超大规模集成电路、LED、TFT-LCD面板制造过程、太阳能硅片的蚀刻与清洗。
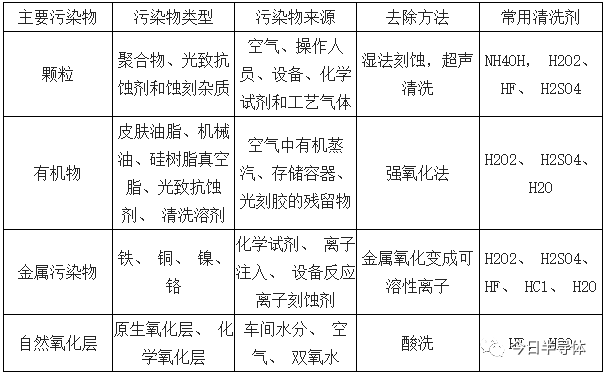
超净高纯试剂的应用多种多样,例如在晶圆生产过程中对于晶圆的清洗,在芯片制造光刻工艺中的刻蚀、显影和洗脱过程,同时在芯片制造和 PCB 板制造中的电镀液(例如硫酸铜)的制备原料硫酸也属于超净高纯试剂范畴。晶圆清洗试剂是前端加工关键工艺。由于集成电路内各元件及连线相当微细,因此制造过程中,如果遭到尘粒、金属的污染,很容易造成晶片内电路功能的损坏,形成短路或断路等,导致集成电路的失效以及影响几何特征的形成。因此在集成电路加工之前,必须对晶圆进行清洗,清除残留在晶圆上之微尘、 金属离子及有机物之杂质。
CMP 研磨液的配置原料中涉及超净高纯试剂的应用,例如其中用作氧化剂的双氧水(H
2O
2)和碱性溶液 KOH。在硅表面处理过程中涉及到碱洗除去 Si 余料和酸洗活化 SiO
2表面过程中分别涉及碱性试剂氨水 NH
3•H
2O 和酸性试剂 H
2SO
4 等。
光刻配套试剂直接影响晶圆光刻图形化效果。在晶圆制造工艺的光刻过程中涉及超净高纯试剂的应用方向包括刻蚀、显影和洗脱三个阶段。
刻蚀过程由于针对所需刻蚀基底不同使用需用的试剂,例如在绝缘层的刻蚀中, SiO
2 绝缘层选用NH4F 和 HF 的混合缓冲液进行刻蚀,利用 NH4F 实现控制 PH 在 3~5 之间;Si
3N
4绝缘层的刻蚀中选用 NH4F 和 HF 混业缓冲液或 H
3PO
4 进行刻蚀;在半导体层刻蚀中,单晶硅半导体层的刻蚀选用 HNO
3 和 HF 的混合溶液共同作用破坏 Si原子之间的化合键实现刻蚀;在导体刻蚀中, 8 寸及以下 Al 制程中,对于 Al 及Al-Si 的刻蚀液常选用 H
3PO
4、 HNO
3 和 HAc 的混合液晶型刻蚀,在 12 寸及以上的 Cu 制程中,由于对于 Cu 的氧化腐蚀比较困难,因此利用腐蚀氧化层的方法从而避免对于 Cu 的腐蚀。
显影液和洗脱液的成分是针对不同的光阻材料设计而成的,此过程涉及的超净高纯试剂包括 H
2O
2、 Na
2SO
3,以及 KOH 和 NaOH等碱性溶液,针对不同的显影液和洗脱液,其配方成分均不相同。
电镀液配套试剂导电液纯度起到核心作用。由于半导体铝制程工艺中金属 Al 采用真空中蒸镀或溅镀的方法,因此不涉及超净高纯试剂的使用;在铜制程中,利用导电盐 CuSO
4、活化剂、缓冲剂和添加剂的混合溶液条件下,通过电化学反应实现电镀铜的过程。此时涉及的超净高纯试剂包括作为溶液的 H
2SO
4。在制备 CuSO
4溶液的过程中, H
2SO
4 也作为重要的导电液起到作用。
综上所述,在超净高纯试剂中 H
2SO
4、 HF、 HNO
3、 HCl 和醋酸等酸性溶液,NH
3•H
2O 和 KOH 等碱性溶液, H
2O
2 等氧化溶液, IPA 等有机溶液均存在加大范围的应用。
据国内统计数据显示,湿电子化学品消耗总量约为 18 万吨/年,硫酸约占27%~33%,双氧水约占 8%~22%,氨水约占 8%,盐酸约占 3%~8%,其他酸(包括硝酸、醋酸、氢氟酸和磷酸等)约占10%~20%,刻蚀剂约占12%~20%,有机溶剂约占 10%~15%。
随着半导体行业的发展,湿电子化学品需求量逐年不断增加,预计至 2020 年国内应用于半导体行业、平板行业的湿电子化学品需求量将超过 80 万吨,各类试剂占比变化幅度略有变化,但是湿电子化学品主要以电子级硫酸、双氧水、氨水、盐酸为主,进行混配和相关添加。
电子级超净高纯硫酸由工业级硫酸制备而来,接触法制备工业硫酸的过程包括:硫铁矿在沸腾炉中加热氧化产生的 SO
2气体在接触室中与催化剂充分接触,氧化成 SO
3,SO
3 在吸收塔中与 98.3%浓硫酸接触,与其中的水分发生化学反应产生硫酸。由于工业硫酸一般为微黄色粘稠液体,含有大量不同价态金属离子和 SO
2、SO
3
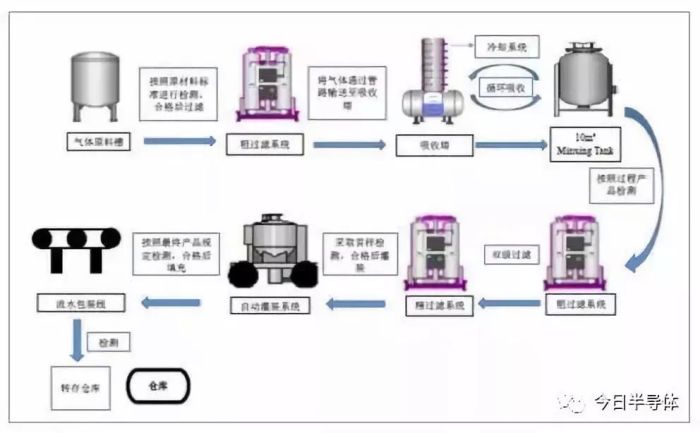
2-、有机物等,因此在提纯过程中先加入氧化剂将低价态还原性的酸根离子进行氧化,此时还原性杂质被氧化产生硫酸和二氧化碳,金属杂质离子以硫酸盐的形态在馏过程中和蒸馏残液体一起留在釜底,从而除去。精馏速度稳定后收集成品在储罐内,用微孔膜过滤除去颗粒,在超净工作台内分装成品,经过多次循环,实现纯度控制。
气体吸收法是在工业硫酸制备的第二步,将产生的 SO
3 直接纯化,后利用超纯水或超纯硫酸直接吸收。向发烟硫酸中添加适量过氧化氢溶液,使其中的 SO
2氧化为 SO
3,随后在发烟硫酸加入降膜蒸发器中,在 90℃~130℃条件下蒸发,蒸发出 SO
3 气体经过除雾剂,除去其中的微量硫酸、亚硝酸基硫酸,通入高纯化惰性气体,混合后进入吸收塔利用电子级超纯水或超纯硫酸直接吸收,冷却后得到超纯硫酸产品,为了进一步满足颗粒要求,在进入吸收塔前进行 1-3阶段过滤,成品超纯硫酸的在氟聚合物衬里的储槽中,吸收过程产生的热量由换热器收集。
2
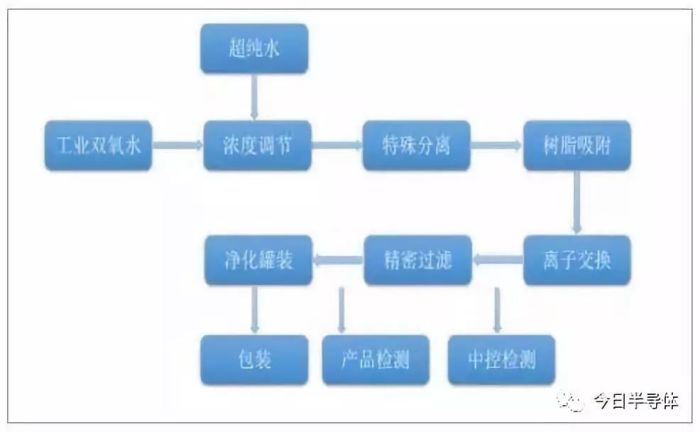
电子级双氧水精制方法有蒸馏法、离子交换法和膜分离法等。
工业 H
2O
2 的制备方法包括电解法、仲醇氧化法和烷基蒽醌法。蒽醌法是工业中生产过氧化氢的最主要方法,其工艺为烷基蒽醌(例如 2-乙基蒽醌)与有机溶剂配置成工作溶液,在压力 0.3MPa,温度 55~65℃条件下和催化剂(例如靶)存在条件下通入 H
2,实现氢化还原后,后续经萃取、再生、精制和浓缩制得质量分数为 20%~30%的过氧化氢水溶液。
目前行业内较为领先的蒸发-精馏法技术由日本三菱瓦斯化学公司开发,将工业H
2O
2 在蒸发器中蒸发,气液混合物经气液分离器分离,蒸汽进入分凝器,部分蒸汽被冷凝下来成为净化产品。离子交换是利用只用阳离子交换膜单项滤除金属离子,其中日本公司提出在工业过氧化氢水溶液中加入絮凝剂,然后利用细滤器过滤除去不溶性二氧化硅;美国公司提出将工业 H
2O
2 溶液流过 2 根混合离子交换柱和 1 根有机物吸附柱从而实现纯化。中国相关公司通过负载螯合剂 SBA-15 分子筛过滤,通过超滤膜过滤从而实现纯化。同时也可以将膜过滤与活性炭吸附和多级精馏配合使用从而实现纯化。
溶剂萃取法是通过工业 H
2O
2 在两种互补相溶的溶剂中的溶解度和分配系数不同,经过反复多次萃取,从而得到纯度较高的 H
2O
2,例如可以在重芳烃和磷酸三辛酯在 30℃~50℃条件下缓和完成萃取;也可利用利用极性溶剂和非极性溶剂混合处理。
综上所述,电子级超净高纯 H
2O
2 的纯化处理过程涉及精密仪器的研发和相关工艺的探索,国内公司目前正在加速追赶,打破海外垄断。
电子级氨水是利用高纯氨气通入高纯水中吸收,经微孔滤膜处理从而获得。传统高纯氨气的合成方法有三种,原料是通过工业合成氨获得。工业合成氨通过原料(N
2和 H
2)、造气、净气、合成氨、分离氨,最终得到工业级氨气,其中 N
2 和 H
2 的催化反应以 Fe 作为催化剂,最终通过不断抽离氨气使得反应向正向移动。当前国内外大型氨厂的合成塔都采用多段(通常是 4 段)绝热反应器,段间用冷原料气冷激,实现 N
2与 H
2 充分反应,最终的氨分离使用降低温度使氨气液化的方法,其他气体如 N
2和 H
2 并不液化从而留回到反应釜中。
传统高纯氨的制备工艺主要有三种,第一种方法:工业氨经三级吸附除去油、水及部分碳氢化合物,通过压膜机压缩后送入部分精馏塔,二级精馏塔除去低沸点杂质,吸附器进一步除水得到高纯氨;第二种方法:工业氨用吸附法除去水,采用间歇精馏法除去低沸点杂质,得到 5N
9 高纯氨;第三种方法:工业氨经过精馏、多重吸附、超滤、终端纯化得到 6N
9 高纯氨。
4
电子级盐酸的制备来自于工业氯化氢的提纯,方法可包括精馏、亚沸蒸馏等方法。
工业上制备盐酸的方法通常是利用 Cl
2 在 H
2 中燃烧产生 HCl, HCl 溶于高纯水从而生产超净高纯盐酸,常因 HCl 含有 Fe
3
+而呈现黄色。近年来,工业中还发展了由生产含氯有机物的副产品氯化氢制盐酸, Cl
2 与乙烯反应,生成二氯乙烷(CH
3CHCl
2),再经过分解反应制备出氯乙烷(CH
3CH
2Cl)和 HCl。
电子级盐酸的制备来自于工业 HCl 的提纯,方法可包括精馏、亚沸蒸馏等方法。其中亚沸蒸馏工艺中包括:蒸馏、过滤与洗涤、吸收和亚沸蒸馏等步骤。其中蒸馏过程是利用沸点差异实现 HCl 与 H
2O 的分离,从而除去 H
2O 中的金属杂质离子,蒸馏后的 HCl 通过过滤除去其中夹杂的固体杂质,经过洗涤的 HCl 被超纯水吸收从而形成超净高纯盐酸。
亚沸蒸馏法是将工业盐酸加热到温度比费电低 5~20℃左右,由于未达到沸点,和液相平衡的气相也就不再大量由大量蒸汽物粒所组成,而是以分子状态与液相平衡,因此蒸汽中极少夹杂或不夹杂带金属离子和固体微粒,从而实现冷凝回流后的液体中金属离子含量低,实现超净高纯化。最终经过纯化获得的超净高纯盐酸经过相关泵输送到 10 级净化箱内,分装于已经利用超净高纯液体清洗干净的石英瓶或聚四氟乙烯瓶中。
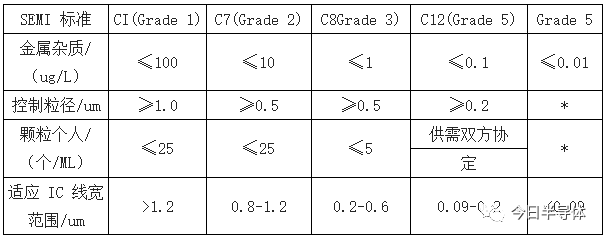
纯度和洁净度对集成电路成品率、电性能及可靠性有十分重要的影响。为了能够规范世界超净高纯试剂的标准,SEMI(国际半导体设备和材料协会)专门制定、规范超净高纯试剂的国际统一标准-SEMI 标准。对于集成电路不同技术水平,所需要湿电子化学品的标准越高,纯度和洁净度的要求也就越高。
目前,国际上制备 SEMI-C1 到 SEMI-C12 级湿电子化学品的技术都已经趋于成熟。随着集成电路制作要求的提高,对工艺中所需的湿电子化学品纯度的要求也不断提高。从技术趋势看,满足纳米级集成电路需求是超净高纯试剂今后的发展方向之一。
目前,国内少数几家企业的产品技术等级能够达到 G2 级,部分公司实现G3 级产品的送样。对于半导体材料领域, 12 寸制程中湿电子化学品技术等级需求一般在 G3 级以上。
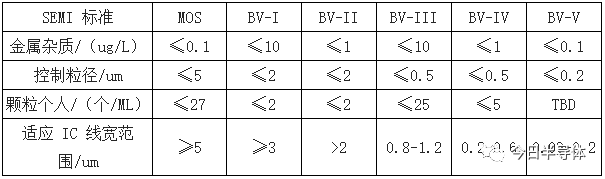
国内超净高纯试剂的分类方式与 SEMI 规定方式略有不同,其中 BV-III 级、BV-IV级和 BV-V 级分别对应 SEMI 标准中 C7(G2)、 C8(G3)和 C12(G4)标准程度。同时
内包括实验纯(LR)、化学纯(CP)、分析纯(AR)、优级纯(GR)等,但是由于产品品类不同,无法实现一一对应。
超净高纯试剂的纯度和洁净度对于生产集成电路的电性能、成品率和可靠性均有严重影响。由于超净高纯试剂分类较多,同时国内试剂各产品研发进度及产业化进程均不相同,因此需要分具体情况客观评价超净高纯试剂的国内外差别。总体看 C12(G4)及其以上级别的产品多数被德国巴斯夫、美国霍尼韦尔、日本关东化学和三菱集团、韩国东进 SEMICHEM 等海外公司垄断。目前国内基于进口替代目标,在 300mm 硅晶圆的制造中主要关注于 C8(G3)级电子化学品的批量生产及进口替代,实现此范围技术突破的公司在市场上具有竞争力。
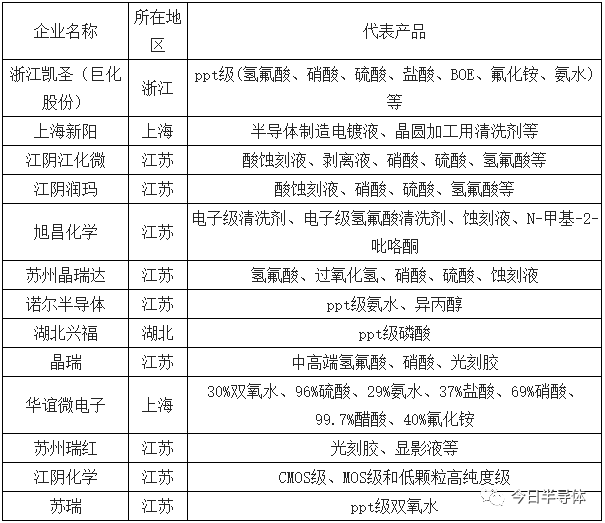
目前国际上的大型湿电子化学品厂商主要有德国的E.Merck 公司、美国的Ashland 公司、Sigma-Aldrich 公司、Mallinckradt Baker 公司、日本的Wako 、Summitomo 等,这几家产能占全球的80%。在国内市场上,湿电子化学品也主要被欧美、日韩企业、台湾的企业所占据。
第一大市场份额,由欧美传统老牌企业的湿电子化学品产品(包括它们在亚洲开设工厂所创的销售额)所占领,其市场份额(以销售额计)约为34%。其主要企业有德国巴斯夫(Basf)公司、美国亚什兰集团、亚什兰化学公司、美国Arch 化学品公司、美国霍尼韦尔公司、AIR PRODUCTS、德国E.Merck 公司、美国Avantor Performance Materials 公司、ATMI 公司等。
第二大市场份额,由日本的十家左右生产企业所拥有,约占30%的市场份额。其大型企业包括关东化学公司、三菱化学、京都化工、日本合成橡胶、住友化学、和光纯药工业(Wako)、stella-chemifa 公司等。
第三大市场份额,主要由中国台湾、韩国、中国大陆企业(即内资企业)生产的湿法电子化学品所占据,三者约占全球市场份额的35%。
受益于本国(地区)下游应用市场的扩大,在平板显示、半导体、太阳能等湿电子化学品市场方面,中国台湾、韩国、中国大陆等国家、地区的湿电子化学品市场扩充快速,替代欧美、日本同类产品的变化速度,表现十分显著,这种三分天下的格局正逐步被打破。中国台湾、韩国、中国大陆的湿电子化学品生产企业,近两三年其生产能力、技术水平及市场规模都得到快速发展。预计在未来几年,中国台湾、韩国、中国大陆等企业所生产的湿电子化学品,在市场占有率方面将有更大的增加。
2016 年国内半导体行业所需的湿电子化学品量为19.33万吨,对应市场规模达到 22亿人民币,预计2020年,国内集成电路所需的湿电子化学品量为 45.37 万吨,对应市场规模将达到 52 亿人民币。2017年我国湿电子化学品市场规模约76.49亿元,同比2016年的63.83亿元增长了19.83%。
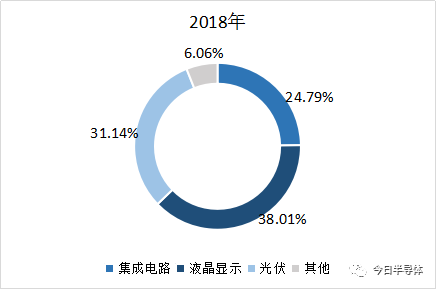
2017年,我国用于半导体、面板和太阳能的湿电子化学品市场需求为 61.8 万吨,其中面板的市场需求最大,达到32万吨,占全部的51.8%。预计,2018年湿电子化学品需求量为69.9万吨,同比增长13.1%,液晶面板是需求增长最快的领域。















加载更多