光学显微镜的主要观察方法之荧光观察
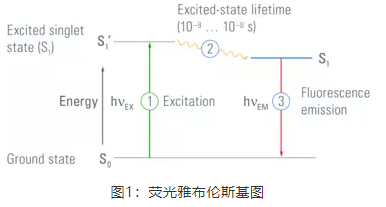
荧光是指荧光物质在特定波长光照射下,几乎同时发射出波长更长光的过程(图1)。当特定波长(激发波长)的光照射一个分子(如荧光团中的分子)时,光子能量被该分子的电子吸收。接着,电子从基态(S0)跃迁至较高的能级,即激发态(S1’)。这个过程称为激发①。电子在激发态停留10-9–10-8秒,在此过程中电子损失一些能量②。电子离开激发态(S1)并回到基态的过程中③,会释放出激发过程中吸收的剩余能量。
荧光分子在激发态驻留的时间为荧光寿命,一般为纳秒级别,是荧光分子本身固有的特性。利用荧光寿命进行成像的技术叫荧光寿命成像(Fluorescence Lifetime Imaging,FLIM),可以在荧光强度成像之外,更加深入地进行功能性精准测量,获取分子构象、分子间相互作用、分子所处微环境等常规光学成像难以获得的信息。
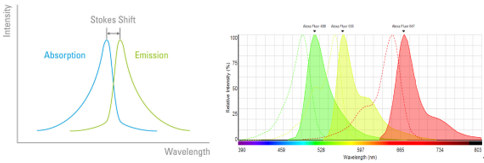
荧光的另一个重要特性是Stokes位移,即激发峰和发射峰之间的波长差异(图2)。通常发射光波长比激发光波长更长。这是由于荧光物质被激发之后、释放光子之前,电子经过弛豫过程会损耗一部分能量。具有较大Stokes位移的荧光物质更易于在荧光显微镜下进行观察。
图2:Stokes位移
荧光显微镜及荧光滤块
荧光显微镜是利用荧光特性进行观察、成像的光学显微镜,广泛应用于细胞生物学、神经生物学、植物学、微生物学、病理学、遗传学等各领域。荧光成像具有高灵敏度和高特异性的优点,非常适合进行特定蛋白、细胞器等在组织及细胞中的分布的观察,共定位和相互作用的研究,离子浓度变化等生命动态过程的追踪等等。
细胞中大部分分子不发荧光,想要观察它们,必须进行荧光标记。荧光标记的方法非常多,可以直接标记(比如使用DAPI标记DNA),或利用抗体抗原结合特性进行免疫染色,也可以用荧光蛋白(如GFP,绿色荧光蛋白)标记目标蛋白,还可以用可逆结合的合成染料(如Fura-2)等。
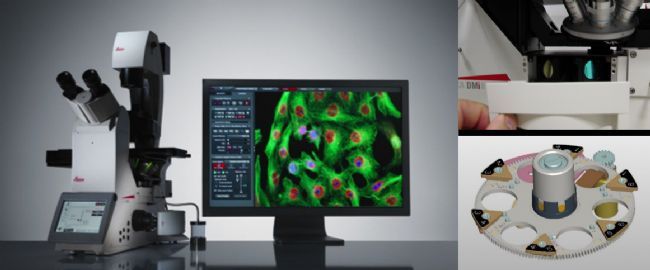
图3:Leica DMi8倒置荧光显微镜及滤片转轮
目前荧光显微镜已成为各个 及成像平台的标配成像设备,是我们日常实验的好帮手。荧光显微镜主要分为三大类:正置荧光显微镜(适合切片)、倒置荧光显微镜(适合活细胞,兼顾切片)、荧光体视镜(适合较大标本,如植物、斑马鱼(成体/胚胎)、青鳉、小鼠/大鼠器官等)。
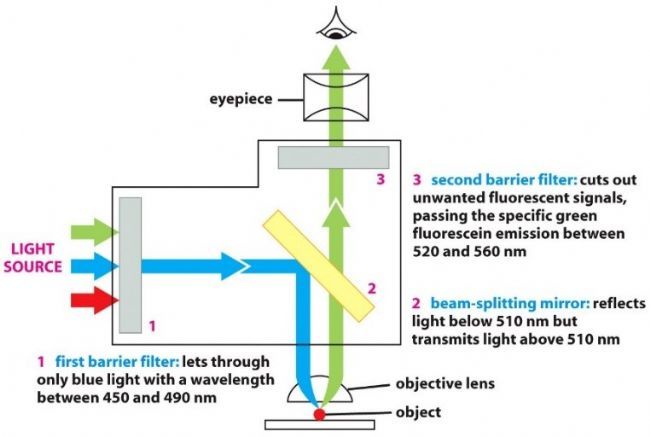
荧光滤块是显微镜荧光成像的核心部件,由激发滤片、发射滤片和二向分光镜三部分组成,安装在滤片转轮里,如Leica DMi8配有6位滤片转轮(图3)。不同的显微镜转轮位数会有区别,也有些显微镜使用滤块滑板。
滤块在荧光成像中起着重要作用:激发滤片选择激发光来激发样品,阻挡其他波长的光;通过激发滤片的光经过二向分光镜(其作用是反射激发光和透射荧光),反射后通过物镜聚焦,照射到样品,激发出对应的荧光即发射光,发射光被物镜收集,透过二向分光镜,到达发射滤片。如图4中:激发波长为450-490nm,二向分光镜反射短于510nm的光、透过长于510nm的光,发射光接收范围为520-560nm。
图4:荧光显微镜光路图
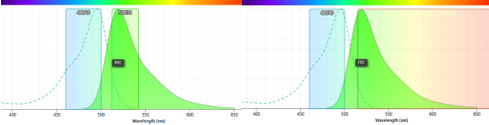
荧光显微镜常用荧光滤块可分为长通(long pass,简称LP)和带通(band pass,简称BP)两种类型。带通通常由中心波长和区间宽度确定,如480/40表示可通过460-500nm的光。长通滤色片如515 LP,表示可以通过波长长于515nm的光(图5)。
图5:FITC光谱曲线及滤片
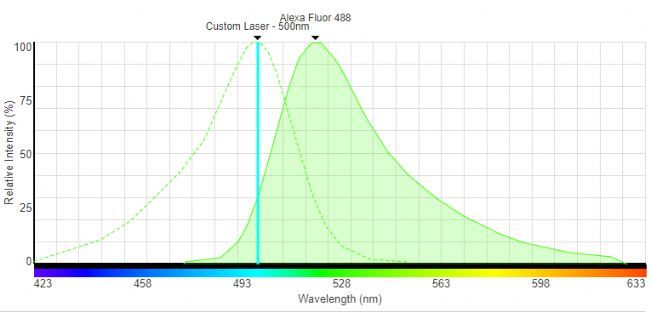
荧光物质具有其特征性激发(吸收)曲线和发射曲线,激发峰为最佳激发波长(激发效率最高,从而可以降低激发光能量,保护细胞和染料),发射曲线为发射荧光波长范围。因此,在实验中,我们会尽可能选择与激发峰最接近的波长进行激发,而接收范围需包括发射峰。如Alexa Fluor 488的激发峰为500nm,在荧光显微镜中可以选择480/40的激发滤片。
图6:Alexa Fluor 488光谱曲线
滤块的详细信息可以在显微镜成像软件里看到。了解染料并找到最匹配样品的滤块对于荧光成像有着至关重要的作用。荧光染料和荧光蛋白的光谱信息一般在说明书中会注明,也可在网上查阅(如https://www.leica-microsystems.com/science-lab/fluorescent-dyes/、https://www.leica-microsystems.com/science-lab/fluorescent-proteins-introduction-and-photo-spectral-characteristics/)。
滤块的选择除考虑荧光探针的激发、发射波长,对于多色标记样品还需考虑是否有非特异激发、是否串色。此外还需考虑所使用的荧光光源,目前常用的荧光光源有汞灯、金属卤素灯,以及近年来飞速发展的LED光源。荧光光源的光谱有连续的和非连续的,在不同波段能量也会不同。LED光源因为其相对较窄的光谱带、更稳定的能量输出、超长的寿命、更安全环保等诸多优点,正逐步成为荧光显微镜的主要光源。
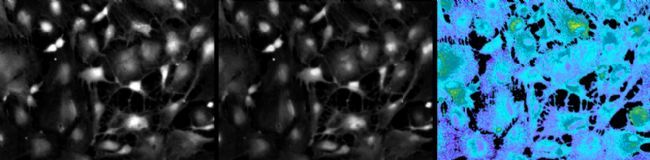
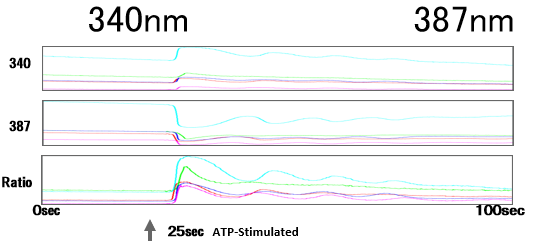
除了显微镜内置的滤块,还有外置快速转轮(图7),徕卡的外置快速转轮相邻位置滤片转换速度为27ms,可实现高速多色实验,如FRET及Fura2比例钙成像(图8)等。
图7:徕卡外置快速转轮EFW
图8:钙成像,Fura2, Cultured hippocampal astrocytes from 18-day-old embryos of Sprague-Dawley rats. Courtesy of: Drs. Kazunori Kanemaru and Masamitsu Iino, Department of Pharmacology, Graduate School of Medicine, The University of Tokyo
丰富多样的荧光显微成像技术
为了满足不同的荧光成像需求,除荧光显微镜外,还发展出了各种荧光显微成像解决方案:
宽场高清成像系统,如Leica THUNDER Imager,采用Leica创新的Clearing专利技术,在成像时高效去除非焦平面干扰信号,呈现清晰图像,同时兼有高速成像的优点;
共聚焦激光扫描显微镜,利用针孔排除非焦平面干扰,实现光学切片,得到高清图像及三维立体图像;
突破衍射极限的超高分辨率显微镜及纳米显微镜,可对小于200nm的精细结构进行观察;
利用多光子激发原理进行厚组织及活体深层成像的多光子成像系统;
具有高时空分辨率的光片成像技术,成像速度快、分辨率高、光毒性低,特别适合进行发育、活体动态观察等研究;
荧光寿命成像(FLIM),不受荧光物质浓度、光漂白、激发光强度等因素的影响,能更加深入地进行功能性精准测量;
荧光相关光谱(FCS)及荧光互相关光谱(FCCS),测量荧光分子的分子数、扩散系数,从而分析分子浓度、分子大小、粘性、分子运动、分子结合/解离、分子的光学特性等;
全内反射荧光显微镜(TIRF),极高的z轴分辨率,非常适合细胞膜表面的分子结构和动力学研究。
荧光显微成像技术应用广泛,种类丰富,而且新技术还在不断涌现,大家可以选择最适合的技术去完成自己的研究。
互联网
展源
何发
相关文章
-
认识荧光显微镜的光立方
2020-05-27
-

【干货】代谢组学中的质谱成像新技术介绍
2021-10-09
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

结构光照明显微镜
2024-04-07
-

网络药理学结合代谢组学研究肾炎康复片治疗糖尿病肾病的作用机制
2021-06-07
-

生物显微镜的光学性能
2020-05-27
-

成像质谱显微镜iMScope QT
2021-03-22
-

Esco Photimax 光学显微镜
2024-03-28


加载更多