分析方法的验证和确认
.png)
.png)
内容
一.法规要求
二.分析方法验证
三.分析方法确认
四.分析方法验证和确认总结
一.法规要求:新版GMP(2010年修订)
第二百二十三条 物料和不同生产阶段产品的检验应当至少符合以下要求:
(一)企业应当确保药品按照注册批准的方法进行全项检验。
(二)符合下列情形之一的,应当对检验方法进行验证。
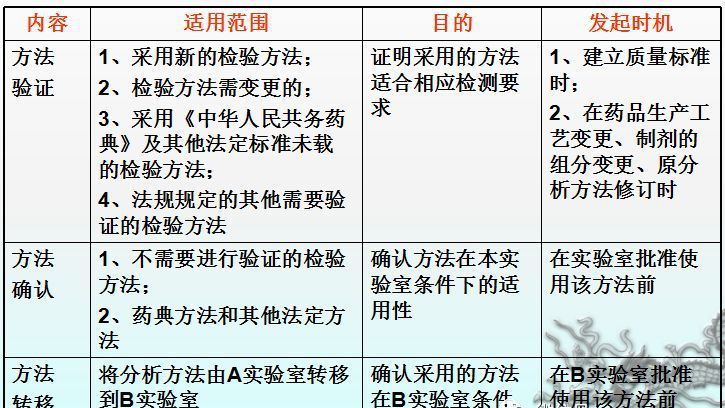
1.采用新的检验方法;
2.检验方法需变更的;
3.采用《中华人民共和国药典》及其他法定标准未收载的检验方法;
4.法规规定的其他需要验证的检验方法。
(三)对不需要进行验证的检验方法,企业应当对检验方法进行确认,以确保检验数据准确、可靠。
法规要求:中国药典(2010年版)范例
1.检验方法和限度。
2.应将该方法与规定的方法做比较试验,根据试验结果掌握使用,但在仲裁时仍以本版药典规定的方法为准。
法规要求:分析方法确认或验证相关指南
.png)
二.分析方法验证
分析方法验证的定义;
分析方法验证的目的;
分析方法验证范围;
分析方法验证的时机;
需验证的分析方法类型;
分析方法验证的具体内容;
验证检测项目小结;
分析方法验证的方式和步骤;
分析方法验证常见问题;
1.分析方法验证的定义
是根据检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。
2.分析方法验证的目的
(1)证明采用的分析方法是科学、合理。
(2)证明分析方法能有效控制药品的内在质量。
♦ 验证过程和结果均应记载在标准起草或修订说明中。
3.分析方法验证范围
(1)适用范围:
化学药品的理化分析方法和仪器分析方法的验证与确认;清洁验证方法的验证。
(2)不适用:
化学药品的微生物方法;生物制品分析方法验证。
4.分析方法验证的时机
(1)建立新的药品质量标准;
(2)药品生产工艺变更;
(3)制剂的组分变更;
(4)对原分析方法进行修订时。
方法验证理由、过程和结果均应记载在药品标准起草说明或修订说明中。
5. 需验证的分析方法类型
(1)鉴别试验;
(2)杂质定量或限度检查(仪器或非仪器检测方法);
(3)原料药或制剂中活性成分以及制剂中选定组分(如,防腐剂等。。。)的定量测定含量测定;
(4)化学药品/中药制剂中其他需控制成分(如,残留物、添加剂等。。。)的测定;
(5)制剂溶出度、释放度等检查;
(6)原料药粒度检测;
6. 分析方法验证的具体内容
(1)专属性;
(2)线性;
(3)范围;
(4)准确性;
(5)精密度;
(6)检测限;
(7)定量限;
(8)耐用性;
(9)系统适用性;
根据检测的类型,采用的技术检测方法,确定具体方法拟订验证的内容。。。
专属性
1.鉴别、杂质和含量测定的方法学验证中应进行专属性研究,证明专属性所采用的方法取决于分析方法的预定检测对象。
2.一种分析方法不太可能对某一特定的被分析物具有专属性(完全辨别),在此情况下,建议采用两种或两种以上的分析方法以达到所需的辨别水平。
鉴别:
合适的鉴别实验应能区别出可能存在结构相似的化合物。可以通过与已知参比物比较,从含有被分析物的样品中得到的正结果和不含被分析物的样品中得到的负结果来确定。此外,也可以采用与被测物结构相似或相关的物质进行鉴别实验。对于这些可能会有潜在干扰的物质的选择应当基于对这些干扰的物质做出合理的科学评判。
含量测定和杂质检测:
对于色谱方法来说,应当用具有代表性的色谱图来证明专属性并在图上适当地标出每一种成分,其他分离技术也应当有相似的考虑。应当在适合的程度上研究关键的色谱分离度。对于关键的分离度,能够通过两个洗脱最靠近的化合物之间的分辨率来证明方法的专属性。
当用非专属性方法做含量测定时,应当采用其他辅助性的分析方法来证明整体的专属性,
例如:
当为了放行而采用滴定法测定原料药含量时,可以合并采用这种含量测定方法以及一种适当的杂质检查方法。
常用的试验方法:
空白阴性对照试验;
比较同一分析系统对照品与供试品相应色谱峰的吸收光谱:
色谱-质谱联用验证待测成分;
线性
线性系指在设计的范围内,测试结果与供试品中被测物浓度直接呈正比关系的程度。
试验方法:
(1)制备至少包含5个浓度(梯度浓度)的对照品溶液,分别进样测定;
(2)以测得的响应信号作为被测物浓度的函数作图,观察是否呈线性;
(3)最小二乘法进行线性回归;
数据要求:
应列出回归方程、相关系数和线性图。
范围
范围系指能达到一定精密度、准确度和线性,测试方法适用的高低限浓度或量的区间。确认方法是通过把含有被测物的样品在范围的两个极端和范围内进行测试,考察是否可达到精密度、准确度的线性的要求。。。
.png)
范围(中药和复方制剂)
含量限度有上下限的,一般设定范围低限为含量限度下限的50~70%,范围的高限为含量限度上限的130~150%。含量限度仅有低限的,一般设定范围为含量限度的50%~70%至含量限度的2~5倍以上。以标示量规定含量限度的,可参照化学药, 一般设定范围为标示量的80%~120%。
含量限度应根据中药制剂实测结果与原料药材的含量情况确定。尽可能多的测定数据才有足够的代表性,至少应有10批以上样品与原料药材数据为依据,一般原粉入药的转移率要求在90%以上。有毒成分及中西药复方制剂中化学药品的含量应规定上下限,上下限幅度应根据测试方法、品种情况、转移率及理论值确定,一般应在±5%~±20%之间,并在安全有效范围内,制定上下限应有充分依据。
准确度
系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。
a.以经典方法的测定值作为真值,建立方法的测定数据与之比较;
(该法适用于化学药品)
b.以加入对照品测定的回收率表示,一般有空白回收(制剂空白)和加样回收测定的方法;
(中药材、复方制剂等)
.png)
准确度-原料药
(1)用已知纯度的被分析物(如,参比物质)进行测定。
(2)用提出的分析方法的检测结果与第二种成熟的分析方法的检测结果做比较,而后者的准确性是有规定的和(或)经确定的。
(3)准确性可以在精密度、线性和专属性建立后,推论而得。
准确度-制剂
(1)用该分析方法测定药物制剂成分与添加的已知量被分析原料药的混合物?
(2)如在不能获得制剂所有成分的样品时,可以将已知量的被分析物加入到制剂中,或者将测得的结果与另一种已鉴定分析方法的分析结果进行比较,而后者的准确性是有规定的和(或)经确定的;
(3)在精密度、线性和专属性建立后,可以推断准确性;
准确度-杂质的定量测定
(1)应当通过用已知量杂质加强样品(原料药/制剂)检测信号的方式来评价准确性。
(2)在不能获得特定杂质和(或)降解产物样品的情况下,可以考虑与另一种成熟的方法所测得的结果做比较;可以使用原料药的响应因子,如,药典方法或经过验证的方法。
(3)应当明确如何确定每个单一杂质或总杂质:
如,所有成分相对于主摹被分析物的重量/重量首分比或峰面积百分比。
某成分含量测定-回收率1
.png)
某成分-回收率2
.png)
某成分含量测定-回收率3
.png)
精密度
精密度系指在规定的测试条件下,同一个均匀供试品,经多次取样测定所得结果之间的接近程度。精密度一般用偏差、标准偏差或相对标准偏差表示。。。
(1)重复性;
(2)中间精密度;
(3)重现性;
精密度-验证方法
.png)
检出限(Limit of Detection,LOD)
检测限系指供试品中被测物能被检测出的最低量。
a.非仪器分析目视法
通过对一系列含有已知浓度分析物的样品进行分析,以确定能够被可靠测定的分析物的最低浓度。
b.仪器法(信噪比法)
该方法仅适用于出现基线噪音的分析方法。信噪比的确定是通过比较含已知低浓度被分析物样品与空白样品的测试信号,确定被分析物可以靠被检测到的最小浓度。通常信噪比为3:1或2:1时,检测限可以被接受。
检测限系指供试品中被测物能被检测出的最低量。
c.响应值的标准差和斜率
检测限(DL)可以表达为:
DL=3.3σ/S式中,σ为响应值的标准差;S为校正曲线的斜率。
斜率s可从被分析物的校正曲线来估算,而σ值可由多种途径估算,例如,基于空白的标准差;基于校正曲线。
数据要求:
(1)应当提供检测限和测定检测限的方法。
(2)如果方法采用目测法和信噪比法,应提供测试图谱。
(3)如果通过计算或外推法得到检测限的估算值,可对一系列或等于检测限样品的独立分析来验证这一估算值。
定量限(Limit of Quantitative, LOQ)
定义:定量限系指供试品中被测成分能被定量测定的最低量,其测定结果应具一定准确度和精密度。杂质和降解产物用定量测定方法研究时,应确定定量限。
试验方法:
(1)目测法;
(2)信噪比法:
以信噪比10:1时的浓度(或量)进样测定,重复测定的响应值应满足精密度要求。
(3)基于响应值的标准差和斜率;
耐用性
定义:
耐用性系指在测定条件有小的变动时,测定结果不受影响的承受程度;
1.耐用性进行评估应当在研制阶段就加以考虑,它取决于所研究的分析方法类型。应表明在对方法参数进行有意改变后,分析方法依然可靠;
2.如果测定的结果表明该方法对分析条件的变化是敏感的,那么这些分析条件就应适当地加以控制或在方法中预先提出告诫。因此,应当对耐用性进行评估,并建立一系列的系统适用性参数(如,分离度实验),以确保该分析方法在任何时候都可以保持有效性;
3.如果测试条件要求苛刻,则应在方法中写明:
考察因素:
分析溶液的稳定性;样品的提取次数、时间;液相色谱方法;流动相pH值变化的影响;流动相组分变化的影响;不同 (和/或供应商);温度;流速;
气相色谱方法:
不同 (不同的批号和/或供应商);温度;流速;固定相;不同类型的载体;
薄层色谱法:
不同品牌的薄层板;点样方式;薄层展开时温度及相对湿度的变化;
试验示例--不同柱温比较
.png)
试验示例--不同检测波长的比较
.png)
试验示例-流动相组成比例变化比较
.png)
某含量测定-提取条件选择
.png)
系统适用性试验
系统适用性实验是许多分析方法的组成部分,这些实验的基本概念是要把由分析设备、电子仪器、实验操作和被分析样品所组成的完整系统进行整体评估。对于特定方法的系统适应性参数的建立依赖于被验证方法的类型。进一步信息可参考药典。
验证检测项目小结
1.鉴别
鉴别的目的在于判定被分析物是目标化合物,而非其它物质,用于鉴别的分析方法要求具有较强的专属性。
2.杂质检查(限度试验、定量试验)
杂质检查主要用于控制主成分以外的杂质,如,有机杂质、无机杂质等。。。
杂质检查要准确反应供试品的纯度特性,可分为限度试验和定量试验两种情况。用于限度试验的分析方法验证侧重专属性和检测限。用于定量试验的分析方法验证强调专属性、准确度和定量限。
3.定量测定
定量测定包括含量测定、制剂的溶出度(释放度)测定等。。。由于,此类项目对准确性要求较高,故所采用的分析方法要求具有一定的专属性、准确度和线性。
4.其他特定检测项目
其他特定检测项目包括粒径分布、旋光度、分子量分布等。。。由于,这些检测项目的要求与鉴别、杂质检查、定量测定等有所不同,对于这些项目的分析方法验证应有不同的要求。。。
需验证项目
.png)
注意:
-表示通常不需要做的项目;
+表示通常需要做的项目;
①假如已做了重现性(见术语表),就不需再做中间精密度。
②分析方法缺乏专属性,可以由其他分析方法来补充。
③有些情况下可能需要。
分析方法验证的方式和步骤
分析方法应给出完成每个分析试验所需的详细步骤:
(1)可能包括供试品、对照品和试剂的配制和制备;
(2)仪器的使用说明;
(3)标准曲线的绘制;
(4)计算公式的使用等信息,
当然,分析方法的内容不仅限于上述信息。
在实际工作中,可以对实验工作进行充分的设计,使得可以同时考察多个适当的验证项目,提供分析方法科学的、综合的能力情况,比如:专属性、线性、范围、准确度和精密度等。
分析方法验证常见问题
药味的选择问题:
(1)供试品溶液制备考察不全面
(2)对照品溶液浓度与供试品不匹配
(3)标准曲线的制备
样品测定不在线性范围之内取样、范围太小、单位等问题
(4)色谱条件的选择
应详述理由并附相关图谱
(5)方法改变后应与原方法作比较
(6)对照品溶液的制备
对照品称量难以达到精密称定的要求
(7)回收率测定问题
耐用性考察问题:
(1)特殊剂型如分散片建议研究建立主要成分的溶出度检查方法 ,限度的制定有时不能照搬二部药典;
(2)单味制剂,应作辅料空白样品,进行空白对照试验;
(3)正文,不规范。
三.分析方法确认
1.分析方法确认:
一个阐述通过已验证方法进行产品测试的条件确实适合于该验证方法的过程。
2.适用范围:
物料和产品中不需要进行验证的检验方法以及药典方法和其他已验证的法定标准。通过方法确认来证明在本 条件下的适用性。
3.不适用于:
日常检验一般理化方法,如,干燥失重、炽灼残渣;分析方法的验证通常在产品的研发阶段已经进行;
应关注不同 之间方法转移时的确认。
采用药典规定的检验方法需要确认的目的:
(1)在于提供第一次使用 的人员、设备和试剂进行法定分析方法确认时得到可接受结果的基本信息。
(2)确认包括所选择的方法性能参数,如,那些在USP<1225>中描述的,是产生相关数据而不是重复验证过程。
(3)方法使用者应有相当的经验、知识并经过培训能够按照书面的法定方法进行操作。由使用者进行方法确认可以提供法定方法能够适合相应的测试目的的信心。
(4)尽管缺认法定方法在真实条件下使用时的适应性不需要进行完整的再验证过程,列在<1225>表2中的一些分析参数可以在确认过程中使用。特定方法的确认仅需要对被认为适宜的参数进行评估。
<1226>法定方法确认:
除非有迹象显示法定方法不适应各论下测试要求,一些基本的常规方法不需要做验证。
基本法定分析方法包括但不限于:
干燥失重、炽灼残渣、各种化学检测如酸度检测,简单的仪器分析,如,用pH值测试仪测定pH值;
药典建议,对于首次使用药典方法进行常规检测的实验,应考虑到任何新的或不同的样品或溶液的处理要求;
.png)
原料药检测方法示例
.png)
.png)


制剂检测方法示例



如果缺少指导书可能影响检测结果, 应具有所有相关设备的使用和操作指导书以及处置、准备检测物品的指导书或者二者兼有。所有与 工作有关的指导书、标准、手册和参考资料应保持现行有效并易于员工取阅。
四.分析方法的验证、确认及方法转移总结
化学先生
展源
何发
相关文章
-

方法验证中方法资源性验证如何确认
2024-01-29
-
.jpg?x-oss-process=image/resize,m_pad,w_80,h_60,color_eeeeee)
方法确认和方法验证的区别
2020-05-27
-

检验方法的验证、确认及计算方法
2023-12-27
-

方法确认与方法验证的区别!
2024-04-30
-

检验方法的验证和确认步骤
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

药品检验方法的验证、确认步骤及详细计算方法
2021-06-01
-

选对 ,快速开发方法
2020-05-27
-

一张表格区分方法验证和确认
2024-02-01

加载更多