多重PCR法检测STEC
多重PCR法检测STEC
产志贺毒素大肠杆菌(STEC)具有很强的致病性,全球范围内由其引发的食物中毒和其他公共卫生事件呈逐年升高之势,严重威胁人类的健康。开发快速可靠的检测手段对其引发的食源性疾病的监测、控制和预防意义重大。本文结合对STEC分子生物学特征的研究,着重介绍了多重PCR检测技术在检测食品中STEC方面的应用。
食源性疾病是当今世界上最广泛的公共卫生问题,其中细菌性疾病以产志贺毒素大肠埃希氏菌(STEC)引起的出血性结肠炎(HC)、溶血尿毒综合征(HUS)和血小板减少性紫癜(TTP)最为严重,因此STEC又称肠出血性大肠埃希氏菌。志贺毒素(STX)对Vero细胞有细胞毒作用,所以STX也叫做Vero毒素(Vero Toxin,VT),STEC也因此被称为VTEC。
自从STEC首次被确认为人类致病菌以来,许多国家由STEC引起的食源性感染的发生几率大幅提高。一方面是由于对STEC认识的逐步深入,另一方面是由于STEC引发的临床疾病死亡率较高。STEC有100余种血清型可产生志贺样肠毒素(如O26、O45、O48、O103、O111、O113、O121、O128、O145、O157和O163等),其中最常见的就是O157:H7。STEC主要寄居在动物肠道中,致病性强,先后在 40 多个国家引发了不同程度的流行病,是世界范围内最危险的食源性致病菌之一。

食品中STEC检测的挑战
从多种类型的食品中检测并分离STEC是一项具有挑战性的工作。一方面是因为食品样品中的STEC污染量可能较低,对方法的灵敏度具有较高的要求;另一方面,食品中的STEC往往受到加工的影响而处于受损状态(如酸性、受热、冷冻、高盐、抗生素环境),复杂的竞争菌群和食品成分会对STEC的检测产生抑制,因此对方法的特异性和抗干扰能力提出了更高的挑战。
传统的STEC检验方法包括营养培养、菌落选择、生化反应特性和志贺毒素检测。由于大肠杆菌O157:H7具有独特的生化特性较易分离,但非O157-STEC的表型却较为复杂和多变,这是采用传统方法开展非O157-STEC检验的最大难题。现已发现STEC存在许多变异株,任何单一方法的检测都可能存在缺陷,如发酵山梨醇的变异株用SMAC培养基就无法分离出来;许多其他菌,如肠致病性大肠杆菌(EPEC)、志贺氏菌、霍乱弧菌也可能产生STX,单纯检测stx基因可能带来假阳性结果。因此灵敏度较高,结果更为准确,重现性较好的基于多重PCR检测的方法受到了越来越多的关注。
建立多重PCR检测方法
多重PCR作为传统PCR的扩展和补充,采用多组引物,可在同一个PCR反应中同时扩增多个目标片段进行检测,相比传统PCR可提供更多的基因信息,因此非常适合复杂的STEC血清型的检测和确认。
STEC的毒力是由多因子决定的,其致病的特征性毒力因子是STX1和STX2,分别由stx1基因和stx2基因编码。因此stx1和stx2是最为经典的多重PCR检测的目标基因。其他毒力因子,如由eae基因编码的紧密素和hly基因编码的溶血素等也是重要的毒力因素,已被作为多重PCR检测的靶序列,用于STEC的特征性鉴定和对潜在的致病性作出前瞻性判定。除了上述4种常见的目标基因之外,还有许多保守序列已被应用到STEC的多重PCR检测中,如uidA、fliC、rfb、ehxA、wzx、wbdI、ihpl和wzy等。
由于食品中的某些成分常常对Taq聚合酶具有抑制作用(如肉制品中的脂类成分等),从而会影响PCR方法的灵敏度,因此在方法开发的过程中应充分考虑这些因素。通常的做法是从食品样本中分离出STEC进行检测,或进行样品稀释,或在PCR试剂中加入某些成分中和抑制,或从增菌液中抽提核酸来消除这些抑制因素的影响。对于食品中的其他菌群的干扰,可以采用酸化的方法进行处理,因为许多STEC对酸性环境都表现出了较好的耐受性。
美国一项长达19年的研究显示:约70%的STEC感染是由6种主要的血清型(O26、O45、O103、O111、O121和O145)引发的。为此,美国农业部(USDA)于2011年9月宣布对这6种非O157型STEC进行检测,“零容忍”受污染食品,并于2012年6月公布了MLG 5B法案,采用自主设计的引物和探针对肉制品中的STEC进行PCR快速检测和确认。USDA农业研究司还与美国杜邦公司签署了一项合作研究和开发协议,将针对6大STEC血清型的多重实时PCR检测技术予以商业化。合作研究包括增菌方法的考量,多重PCR条件的优化以及疑似阳性样本的确认方法。
USDA与杜邦BAX系统的STEC多重PCR检测方法均分为两大步。首先以毒力基因stx(包括stx1和stx2)及eae为目标基因,初筛肉制品中的STEC;然后,初筛阳性的样本(stx与eae均呈阳性的样本)再以与O抗原簇相关的保守序列(如wzx、wbdI和16S RNA等)为目标基因继续筛查特定的STEC血清型。该技术路线和检测策略同样也被法国食品安全局和欧洲标准委员会所推荐。
杜邦公司分别于2010年和2011年推出了大肠杆菌O157:H7和STEC多重实时PCR检测试剂盒。这两种试剂盒能与杜邦的BAX System全自动病原微生物快速检测系统配套使用,可快速、准确、标准化地检测食品中的O157和非O157型STEC,并可进一步筛查MLG 5B法案所规定必检的6大非O157 STEC血清型。BAX系统已经通过了美国官方分析化学家协会和法国标准化委员会的验证。
为了进一步实现BAX系统O157:H7和STEC检测方法的标准化、一致性和高效率,提升用户的使用体验,在方法的设计之初,科研人员就已充分考虑各种因素,如增菌培养基、温度、时间、裂解酶、抗PCR抑制、DNA聚合酶、PCR程序、引物及探针的选择和设计等等。进行BAX检测时,多种食品样品均可采用TSB一步增菌(只需9h),无需IMS富集和核酸抽提,仅需使用相同的裂解酶热处理即可,样品处理的步骤也大大简化。PCR检测程序的标准化使得裂解产物可在同一批次的反应中同时进行多种STEC血清型的检测和确认,效率和灵活性也因此得到大幅提升。多重PCR检测还采用了Scorpion探针技术,检测的效率、灵敏度、准确性和特异性因此获得了更好的提升。
BAX STEC检测法也与USDA的MLG 5B方法保持了高度的一致性,并于2012年6月通过了USDA食品安全检验局的认证,可与USDA的方法可等同使用。BAX方法无需IMS富集和核酸抽提,药片化的试剂已经预装了PCR所需的全部试剂,包括引物、DNA聚合酶、阳性内参和脱氧核苷酸等,保质期长达3年,检验过程也十分简单,PCR反应程序均为内设,结果也采用自动分析,可最大程度地减少主观因素和交叉污染,提升稳定性和重复性,对食品中的背景菌和抑制因子也有较好的抗干扰作用,较常规的PCR检测具有更为突出的优势。
多重PCR检测的验证与比较
材料与方法
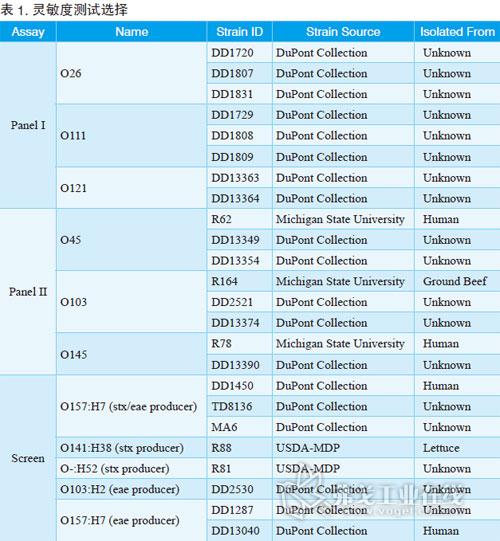
BAX系统STEC检测试剂盒;Screen(筛查)试剂盒;Panel I试剂盒(确认E.coli O26、O111和O121);Panel II试剂盒(确认E.coli O45、O103和O145);BAX全自动病原微生物快速检测系统;TSB肉汤;BHI肉汤。菌株选择请见表1。
检测方法
将菌划线至BHI琼脂上,选取一个菌落接种到BHI培养基中41℃下孵育过夜。接着将培养基梯度稀释,每个梯度将20μl的样品加入到200μl的裂解液中,并于37℃下加热20min,然后在95℃加热10min,在冷却模快下冷却至少5min。最后,将30μl的溶菌液加入到含有PCR药片试剂的管子中,并放入BAX系统中运行即可。
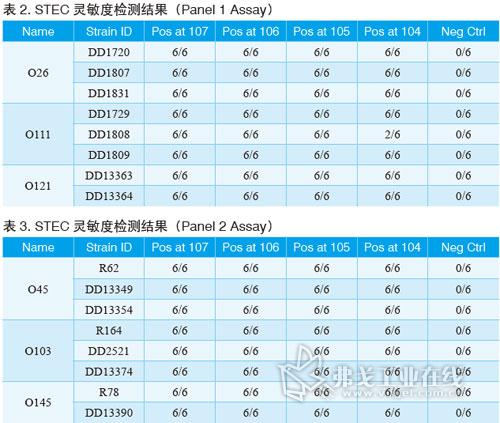
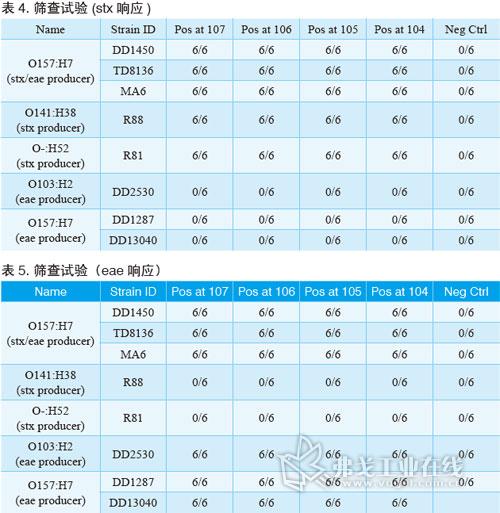
结果
经过验证,BAX系统STEC检测试剂盒对代表菌株的检测灵敏度能低至增菌后104cfu/ml。
小结
强致病性的STEC已成为继沙门菌和弯曲菌之后的第三大流行菌群,开发快速可靠的STEC检测手段十分必要。食品中的STEC由于其较低的致病量,较低的污染水平以及复杂的血清型,一直是检测的难点。传统的表型、生化和免疫的方法均无法有效地将食其从高污染水平的竞争菌群中筛查出来。而多重PCR检测手段,因其针对STEC特有的多个毒力基因为检测目标,有着较高的灵敏度和准确性,在STEC快速检测方面有着十分光明的应用前景。
杜邦中国集团有限公司
展源
何发
相关文章
-

多重PCR法检测产志贺毒素大肠杆菌(STEC)
2020-05-27
-

多重PCR检测技术在检测食品中STEC方面的应用
2020-05-27
-

QC, IQC, IPQC, QA,到底是什么鬼?
2020-05-27
-

AAS法分析茶叶中的铅,镉,砷
2020-05-27
-

红外光谱分析,你了解多少?
2021-01-11
-

HPLC检测器,你了解吗?
2024-03-06
-

三聚氰胺,你还要害多少人
2020-05-27
-

超净工作台原理,使用与维护
2020-05-27
-

选对 ,快速开发方法
2020-05-27

加载更多